Cadre juridique :
Lorsqu’un titulaire souhaite enregistrer un médicament dans un pays, il dépose auprès des autorités de santé un dossier de demande d’autorisation de mise sur le marché (AMM).
Une fois l’AMM obtenue, ce dossier n’est pas destiné à rester figé et inchangé. A chaque changement impactant le produit, que ce soit (par exemple) un changement de fabrication, de contrôle, d’indication thérapeutique, de conditionnement, etc., le titulaire doit déposer auprès des autorités de santé une notification ou une demande de variation.
Une variation est donc une modification de l’autorisation de mise sur le marché.
Il existe également d’autres types de modifications de l’AMM, telle que les extensions d’AMM.
Les modifications des termes d’une autorisation de mise sur le marché européenne sont prévues par la directive 2001/83/CE et le règlement (CE) N° 726/2004, et détaillées par le règlement (CE) N° 1234/2008 du 24 novembre 2008 concernant l’examen des modifications des termes d’une AMM de médicaments à usage humain et de médicaments vétérinaires (ci-après dénommé règlement « Modifications ») .
Il existe ainsi différents types de modifications :
— modifications mineures de type IA,
— modifications mineures de type IB,
— modifications majeures de type II,
— extensions,
— mesures de restriction urgentes pour des raisons de sécurité.
Toute modification doit être positionnée dans une des catégories ci-dessus. Toutefois, dans certains cas, leur positionnement en variation de type II (majeur) ou en demande d’extension n’est pas simple.
Définitions :
1. Variation type II
Les variations de type II sont dites majeures. Il s’agit de modifications qui ne sont pas des extensions d’AMM et qui peuvent avoir des conséquences significatives en termes de qualité, sécurité et efficacité. Ce type de variation est généralement évalué en 60 jours mais des durées d’évaluations plus courtes (30 jours, variations liées à des sujets de sécurité) ou plus longues (90 jours, extension d’indication) peuvent être nécessaires.
2. Extension AMM
Certaines modifications apportées à une AMM doivent être considérées comme modifiant fondamentalement les termes de cette autorisation et ne peuvent donc pas être accordées à la suite d’une procédure de variation. L’annexe I du règlement «Modifications» énumère les modifications devant être considérées comme des extensions :
– Modifications de la (des) substance(s) active(s)
a) remplacement d’une substance chimique active par un complexe/dérivé de sels/d’esters différent, avec la même fraction thérapeutique, si les caractéristiques d’efficacité/de sécurité ne présentent pas de différences significatives;
b) remplacement par un isomère ou un mélange d’isomères différents, remplacement d’un mélange par un isomère unique (par exemple remplacement d’un racémique par un énantiomère unique), si les caractéristiques d’efficacité/de sécurité ne présentent pas de différences significatives;
c) remplacement d’une substance biologique active par une substance ayant une structure moléculaire légèrement différente, si les caractéristiques d’efficacité/de sécurité ne présentent pas de différences significatives, à l’exception:
— des modifications de la substance active d’un vaccin saisonnier, prépandémique ou pandémique contre la grippe humaine,
— du remplacement ou de l’ajout d’un sérotype, d’une souche, d’un antigène ou d’une combinaison de sérotypes, de souches ou d’antigènes, pour un vaccin vétérinaire contre la grippe aviaire, la fièvre aphteuse ou la fièvre catarrhale,
— du remplacement d’une souche, pour un vaccin vétérinaire contre la grippe équine;
d) modification du vecteur utilisé pour produire l’antigène ou la matière d’origine, notamment une banque de nouvelles cellules mères provenant d’une source différente, si
les caractéristiques d’efficacité/de sécurité ne présentent pas de différences significatives;
e) utilisation d’un nouveau ligand ou mécanisme de couplage dans un médicament radiopharmaceutique, si les caractéristiques d’efficacité/de sécurité ne présentent pas de différences significatives;
f) changement du solvant d’extraction ou du ratio substance végétale/préparation à base de celle-ci, si les caractéristiques d’efficacité/de sécurité ne présentent pas de différences significatives.
– Modifications du dosage, de la forme pharmaceutique et de la voie d’administration
a) changement de la biodisponibilité;
b) changement de la pharmacocinétique, c’est-à-dire de la vitesse de libération;
c) changement ou ajout d’un dosage/d’une activité ou ajout d’un nouveau/d’une nouvelle;
d) changement ou ajout d’une forme pharmaceutique ou ajout d’une nouvelle;
e) changement ou ajout d’une voie d’administration ou ajout d’une nouvelle.
– Autres changements apportés aux médicaments vétérinaires destinés à être administrés à des animaux producteurs d’aliments: changement ou ajout d’espèces cibles.
Conformément à l’article 19 dudit règlement, une demande d’extension est évaluée suivant la même procédure que l’autorisation initiale de mise sur le marché à laquelle elle se rapporte. L’extension donne lieu à l’octroi d’une nouvelle autorisation de mise sur le marché (procédures nationales, MRP, et DCP) ou est incluse dans l’autorisation initiale à laquelle elle se rapporte (procédure centralisée). Dans tous les cas, une nouvelle AMM obtenue par cette voie réglementaire est intégrée à l’AMM globale et ne permet pas d’obtenir une protection des données supplémentaire (sauf cas d’extensions d’indication « significative » basée sur des données comparatives).
Le calendrier d’évaluation pour une extension est le même que celui d’une demande d’AMM initiale.
En pratique
L’expérience a montré des erreurs de classification entre les demandes d’extensions et les variation notamment en ce qui concerne les formes pharmaceutiques ou les dosages. Le « GUIDELINE ON THE CATEGORISATION OF EXTENSION APPLICATIONS (EA) versus VARIATIONS APPLICATIONS (V) », bien qu’ancien maintenant, reste utile pour harmoniser la définition des termes afin d’aider dans la classification des demandes.
Un dosage différent (tel que défini dans le guideline ci-dessus) ou toute autre modification de la ou des substances actives (telles que définies à l’annexe I du règlement (CE) n° 1234/2008) donne lieu à une demande d’extension.
La suppression d’un dosage entraîne une variation. Dans les cas où un dosage donné a reçu une autorisation de mise sur le marché distincte de l’autorisation de mise sur le marché pour d’autres formes pharmaceutiques ou dosages, la suppression du premier ne constitue pas une variation mais le retrait de l’autorisation de mise sur le marché.
Par exemple, l’ajout ou le remplacement d’un dispositif de mesure ou d’administration qui ne fait pas partie intégrante de l’emballage primaire est une variation, à moins que ce changement ne s’accompagne d’une modification du dosage. Cela inclut par exemple l’ajout ou le remplacement d’aiguilles, de pansements, de tampons d’alcool.
L’ajout ou le remplacement d’un dispositif faisant partie intégrante de l’emballage primaire constitue une variation, sauf si la modification entraîne un changement du dosage, de la forme pharmaceutique ou de la voie d’administration, pour lequel une demande d’extension doit être demandée.
L’ajout d’une forme pharmaceutique dédiée à une utilisation dans la population pédiatrique non encore autorisée, constitue une extension d’AMM.
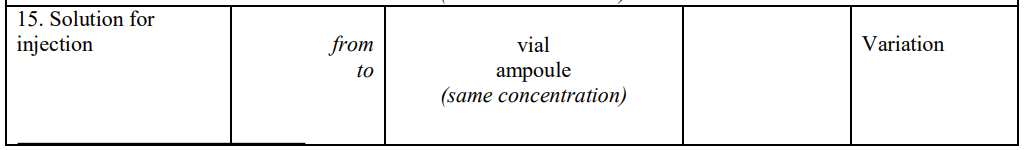

A noter que les demandes de variations peuvent être groupées à une demande d’extension d’AMM. La durée d’évaluation appliquée aux variations sera celle de l’extension d’AMM.
En résumé
Hormis la question sur le positionnement réglementaire de votre demande de modification (variation ou extension), de nombreuses questions pratiques peuvent se poser lors de la constitution du dossier :
– Mon nom de marque sera-t-il impacté ?
– Comment dois-je présenter ma demande d’extension ?
– Quelles données devrais-je générer ?
– Puis-je grouper la soumission d’extensions avec d’autres types de variations ?
– Dois-je répondre à des exigences pédiatriques dans ma demande d’extension ?
– Comment dois-je intégrer cette extension dans l’eCTD ?
Le guideline « European Medicines Agency post-authorisation procedural advice for users of the centralised procedure” donne également des précisions sur les variations ou les demandes d’extensions .
Faites appel à ATESSIA pour vous accompagner dans l’élaboration de la stratégie réglementaire et la rédaction de vos dossiers de demandes de variations ou d’extension, quelle que soit la procédure d’enregistrement.
Cet article a été rédigé par Stéphanie Durlin.

