L’éducation thérapeutique du patient versus les programmes d’apprentissage : quel rôle pour l’industrie pharmaceutique ?
> Définition et contenu
Plusieurs définitions peuvent être données de l’éducation thérapeutique du patient (ETP).
L’Organisation mondiale de la santé (OMS) a donné la définition suivante en 1996 : « l’éducation thérapeutique du patient vise à aider les patients à acquérir ou maintenir les compétences dont ils ont besoin pour gérer au mieux leur vie avec une maladie chronique ».
En 2007, la Haute Autorité de Santé (HAS) donne une précision sur les finalités spécifiques de l’éducation thérapeutique, qui sont :
- « L’acquisition et le maintien par le patient de compétences d’autosoins ;
- La mobilisation ou l’acquisition de compétences d’adaptation ».
La loi n° 2009-879 du 21 juillet 2009 portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires (dite loi HPST), l’ETP est définie comme étant inscrite « […] dans le parcours de soins du patient. Elle a pour objectif de rendre le patient plus autonome en facilitant son adhésion aux traitements prescrits et en améliorant sa qualité de vie. Elle n’est pas opposable au malade et ne peut conditionner le taux de remboursement de ses actes et des médicaments afférents à sa maladie ».
L’ETP telle que prévue dans le Code de la santé publique se décline en trois actions distinctes :
- Les programmes d’éducation thérapeutique du patient, conformes à un cahier des charges national, sont mis en œuvre au niveau local après déclaration auprès des agences régionales de santé (ARS). Ils sont proposés au malade par un professionnel de santé et donnent lieu à l’élaboration d’un programme personnalisé ;
- Les actions d’accompagnement, conformes à un cahier des charges national, ont pour objet d’apporter une assistance et un soutien aux malades, ou à leur entourage, dans la prise en charge de la maladie ;
- Les programmes d’apprentissage ont pour objet l’appropriation par les patients des gestes techniques permettant l’utilisation / l’auto-administration d’un médicament le nécessitant. Ces programmes sont mis en œuvre par des professionnels de santé intervenant pour le compte d’un opérateur pouvant être financé par l’entreprise se livrant à l’exploitation du médicament. Le programme d’apprentissage est proposé par le médecin prescripteur à son patient. C’est dans ce cas l’ANSM qui autorise leur mise en œuvre, après avis d’une association de patients agréée. L’industriel dépose à cette fin un dossier de demande d’apprentissage, justifiant du bénéfice attendu pour le patient.
> Objectifs de l’ETP
L’ETP repose sur une approche individualisée, prenant en compte les spécificités de chaque patient. Elle implique une collaboration étroite entre le patient, les professionnels de santé et souvent son entourage. L’objectif est de favoriser une compréhension approfondie de la maladie, de ses implications et des traitements associés. Cette approche englobe non seulement les aspects médicaux, mais aussi les aspects psychologiques, sociaux et environnementaux liés à la santé.
- Compréhension de la maladie : L’ETP permet au patient de comprendre les mécanismes de sa maladie, ses symptômes, ses traitements et leurs effets. Une meilleure connaissance favorise l’adhésion au traitement et la prévention des complications.
- Acquisition de compétences : Les patients apprennent à gérer leur traitement, à reconnaître les signes précurseurs de complications et à adopter des habitudes de vie favorables à leur santé.
- Autonomie et prise de décision : L’ETP vise à renforcer l’autonomie du patient en lui donnant les outils nécessaires pour participer activement aux décisions concernant sa santé.
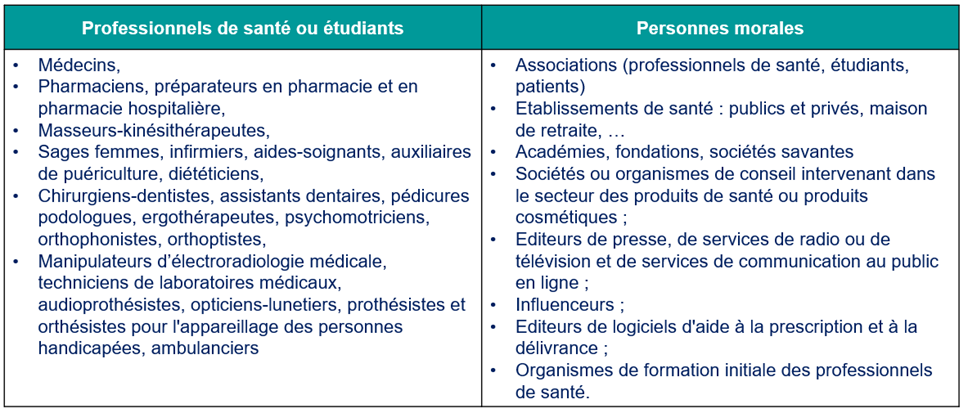
> Qui peut mettre en place ce type de programme ?
| Professionnels de santé | Autres acteurs | Personnes morales |
| > Médecins et Spécialistes : Ils jouent un rôle essentiel dans la définition des objectifs thérapeutiques et dans la validation des contenus éducatifs ; > Infirmiers et Infirmières : Ils sont souvent en première ligne pour délivrer l’éducation et le suivi éducatif auprès des patients ; > Pharmaciens : Ils peuvent contribuer à expliquer les traitements et leur posologie ; > Psychologues ou Psychiatres : Ils interviennent pour aider les patients à gérer le stress et l’impact psychologique de la maladie. | > Éducateurs Spécialisés : Ils sont formés spécifiquement pour dispenser l’ETP ; > Patients Experts : Des personnes vivant avec la même pathologie peuvent partager leur expérience et apporter un soutien précieux. | > Un établissement de santé (public ou privé) ; > Une structure d’exercice collectif (centre de santé/maison de santé/pôle de santé) ; > Un réseau de santé ; > Une association ; > L’Assurance maladie dans le cadre des centres d’examens de santé et la Sécurité sociale agricole ; > Une mutuelle ou une autre assurance complémentaire ; > Une fondation ; > Une municipalité. |
> L’industriel et son médicament, au cœur de l’ETP… mais avec une marge de manœuvre réduite :
- Des médicaments toujours plus innovants
- Des pathologies demandant des connaissances de plus en pointues au patient / des gestes techniques notamment en cas d’auto-administration des médicaments
- Des enjeux d’image et de communication, mais aussi de promotion de la santé publique peuvent amener le laboratoire à souhaiter soutenir un programme d’ETP
Il est essentiel pour un industriel souhaitant utiliser le levier de l’ETP de connaître les rôles et le niveau d’implication qui lui sont autorisés afin de rester conforme à la législation.
Enfin, mettre en œuvre un programme d’ETP sans y être autorisé est sanctionnable à hauteur de 30 000 euros d’amende.
> Conclusion
L’éducation thérapeutique du patient représente une évolution majeure dans la manière d’aborder la santé et la maladie. Dans un monde où il devient courant que les patients deviennent experts de leur maladie, elles sont un outil pour eux pour comprendre, participer activement à leur traitement et adopter des comportements favorables à leur santé, tout en contribuant à une prise en charge globale et personnalisée.
Cependant, le rôle de l’exploitant d’un médicament est encadré et nécessite une analyse des projets au cas par cas. Dans un tel contexte, l’industriel a un rôle à jouer, tout en tenant compte de la complexité réglementaire imposée par le dispositif et la nécessité de se tenir à l’écart des multiples risques liés à son domaine d’activité hautement régulé (requalification promotionnelle, contact avec les patients, octroi d’avantages aux patients ou aux professionnels de santé).
Article rédigé par Zarine RAMJAUNY, Consultante Juridique